Rabia Paralítica Bovina (RPB)
Autor del documento
Nombre: César Lara González
Puesto: Técnico en animales de producción
Teléfono: 999 159 6330
Mail: clara@biozoo.com.mx
La rabia es una enfermedad infectocontagiosa, aguda y mortal, que tiene un alto tropismo por el sistema nervioso central, provocada por el virus de la rabia, uno de los 16 virus que componen el género Lyssavirus de la familia Rhabdoviridae, es de distribución mundial, de notificación obligatoria y presenta un período de incubación relativamente largo. Puede afectar a cualquier animal de sangre caliente, excepto las aves. Es transmitida al hombre o animales principalmente por la saliva de algún animal enfermo o material contaminado, tal como el consumo de cadáveres infectados e incluso se tienen reportes de humanos que han adquirido la enfermedad al estar expuestos a aerosoles.
Situación actual en el mundo, América Latina y en México
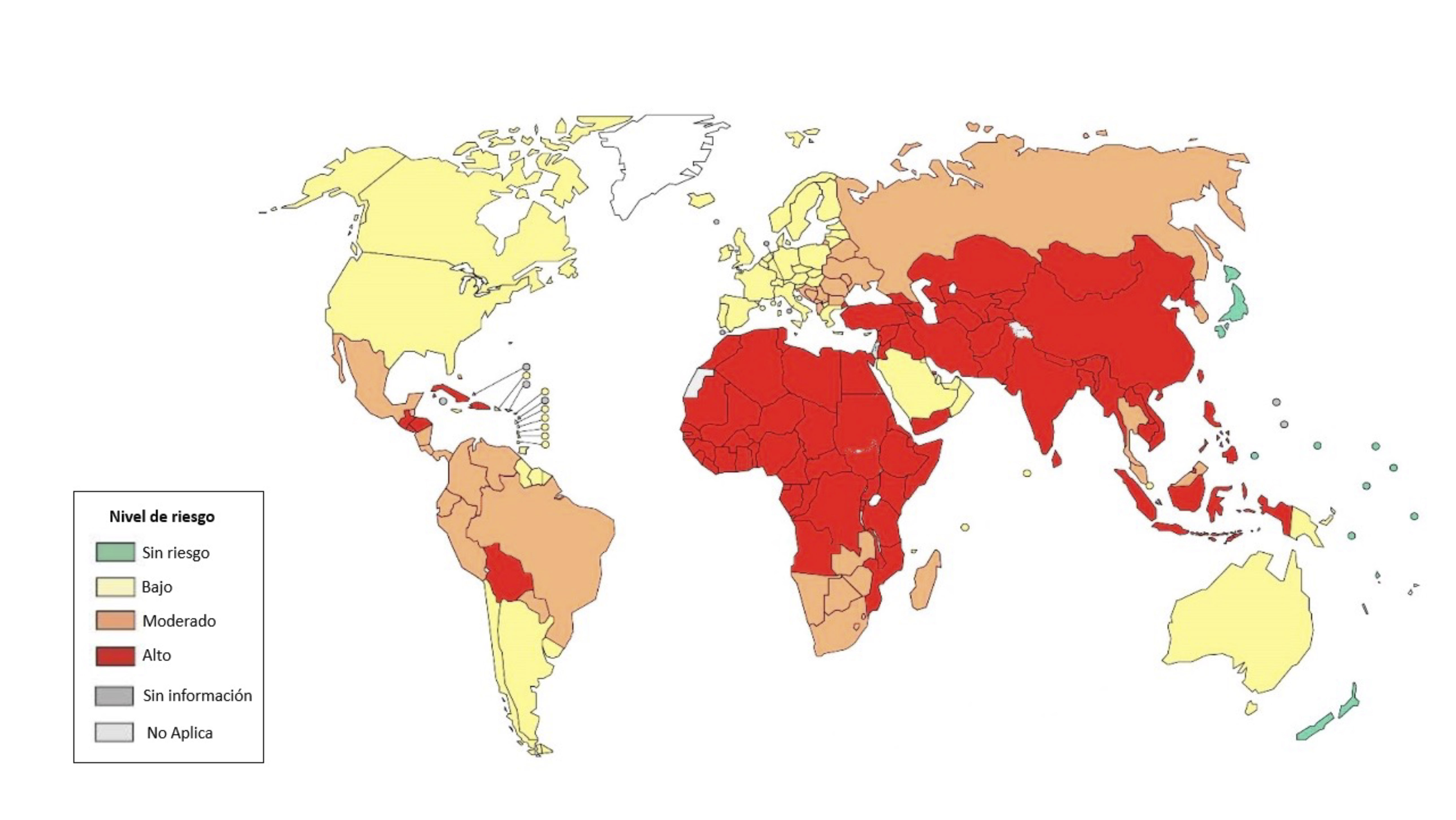
La rabia es una enfermedad aun desatendida y los datos son débiles en los lugares donde no hay un control o vigilancia, tales como África y Asia. En este sentido, para sacar estimaciones se han tenido que extrapolar datos con base a criterios epidemiológicos, socioeconómicos y geográficos. En la Figura 1 se observan los países y zonas clasificadas como de riesgo nulo, bajo y alto de circulación del virus de la rabia y otros Lyssavirus (OMS, 2018).
Figura 1: Países y zonas clasificadas como de riesgo nulo, bajo y alto de circulación del virus de la rabia y otros Lyssavirus.
Mapa Rabia
En el continente americano los murciélagos hematófagos son la principal fuente de casos de rabia humana. En las zonas tropicales y subtropicales la rabia que transmiten los murciélagos vampiros es también una de las principales causas de mortalidad del ganado, afectando tanto a los agricultores de subsistencia como a los comerciales en toda la zona de distribución de este murciélago (desde Argentina y Uruguay hasta el norte de México), incluso en regiones que por décadas se habían considerado libres de esta enfermedad, se han presentado con mayor frecuencia ataques al ganado por parte de murciélagos hematófagos del genero Desmodus rotundus.
La rabia paralítica bovina (RPB) o derriengue se considera una enfermedad epidémica y recurrente causada por el virus rábico transmitido por el vampiro D. rotundus, que afecta principalmente a los bovinos, equinos, con menor frecuencia a otras especies domésticas como ovinos, caprinos, cerdos, algunos animales silvestres y al hombre, en bovinos suele estar caracterizada por la parálisis del tren posterior.
De acuerdo con los reportes de la dirección de campañas zoosanitarias del SENASICA actualmente la RPB se considera endémica en México. Se distribuye desde el sur de Sonora hasta Chiapas y por la costa del Golfo de México desde el sur de Tamaulipas hasta la península de Yucatán. A pesar de las estrategias implementadas por autoridades y ganaderos como la vacunación, captura de murciélagos, entre otras, para controlar y disminuir la RPB, durante el año 2021 se reportaron 230 casos distribuidos en 20 estados del país, donde Veracruz fue el estado que reportó el mayor número de casos positivos con 50; debido a que es una entidad de clima cálido-húmedo con temperatura promedio anual de 23°C y humedad relativa del 75%. Estos factores son ideales para que el murciélago hematófago (D. rotundus) se reproduzca, lo que favorece la incidencia de la rabia en la zona. Después de Veracruz, los estados con mayor cantidad de focos reportados son Nayarit (26), Puebla (26), Chiapas (22), Yucatán (19), Jalisco (16), San Luís Potosí (13), Guerrero (12) e Hidalgo (12). (Gráfica 1).
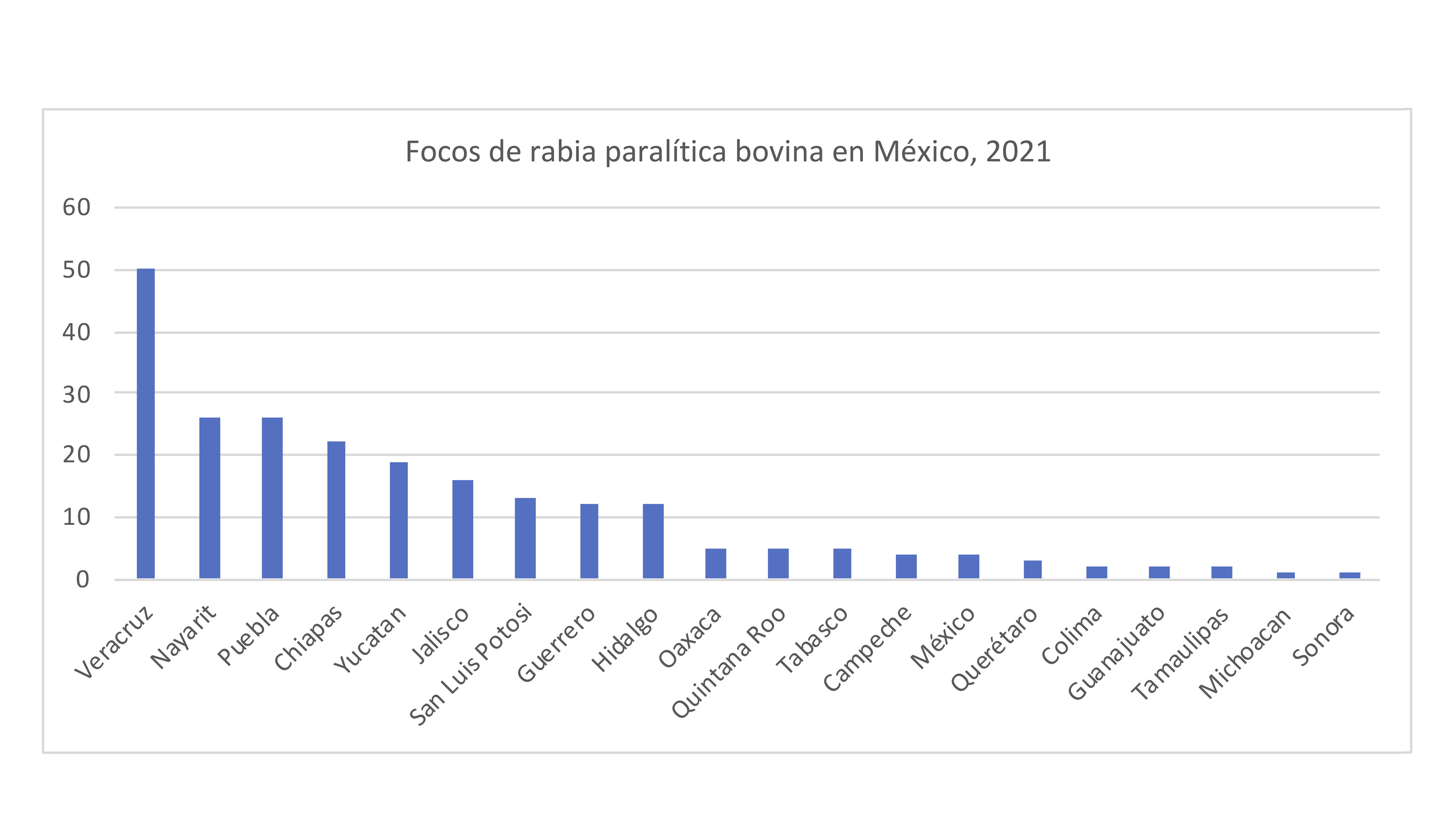
Grafica01 Rabia
Fuente: https://dj.senasica.gob.mx/AtlasSanitario/storymaps/rpb.html#
Comportamiento epidemiológico en México
En México, la rabia urbana se ha reducido significativamente durante la última década gracias al control canino intensivo y las campañas de vacunación; sin embargo, la rabia transmitida por animales silvestres, en especial por quirópteros, ha ido en aumento. Los ataques por D. rotundus al ganado son cada vez más frecuentes (Gráfica 2), incluso en regiones que por décadas se habían considerado libres de RPB.
Gráfica 2: Número de especies ganadera afectadas por el virus de la rabia en México durante el 2021.
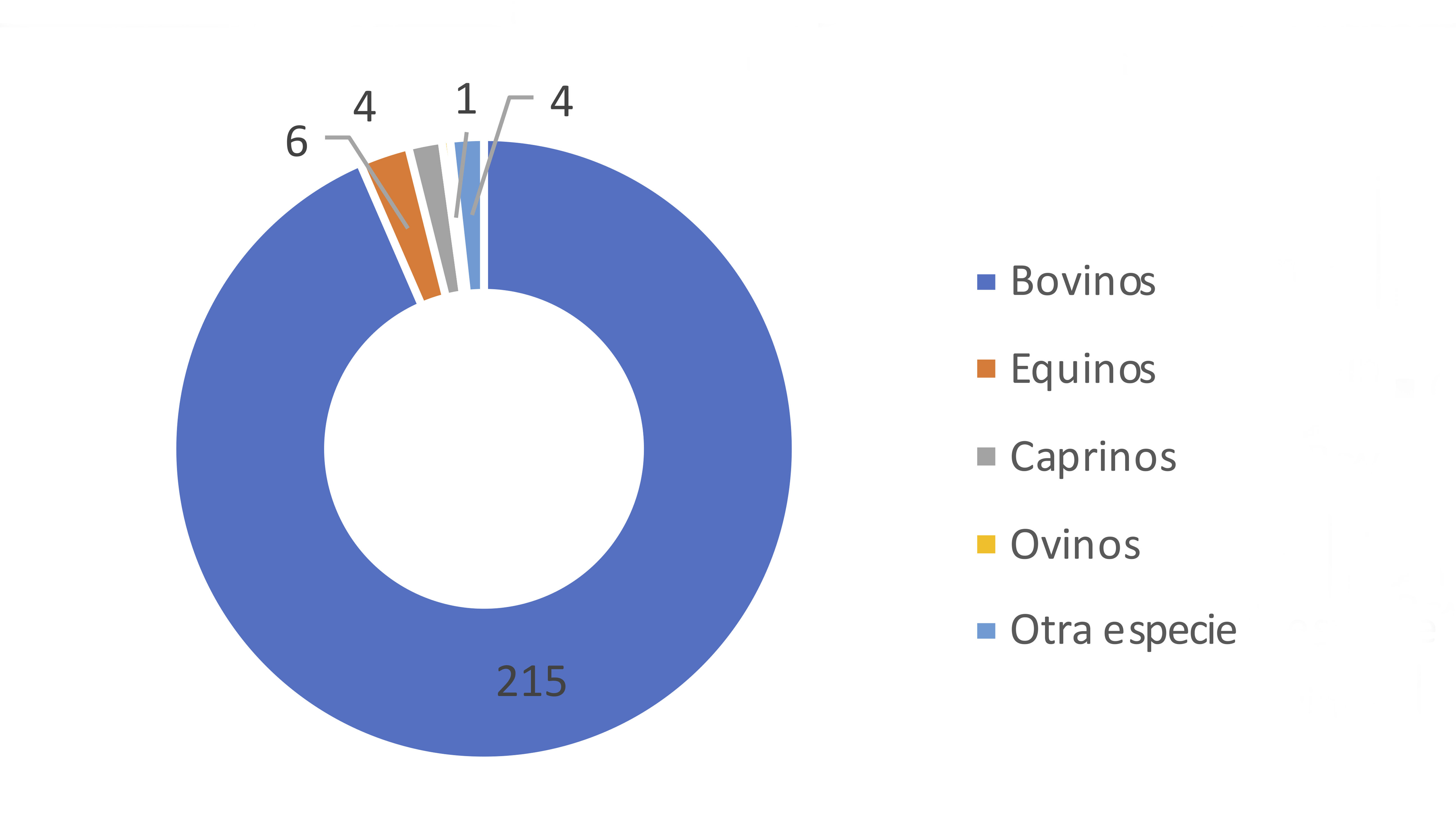
Grafica02 Rabia
Fuente: https://dj.senasica.gob.mx/AtlasSanitario/storymaps/rpb.html#
Al igual que en muchos otros países, en México existe un considerable subregistro de casos debido principalmente a la falta de suficientes laboratorios especializados con capacidad para realizar el diagnóstico. Se considera que, por cada caso de rabia notificado existen diez que no se informan. Se ha establecido que además de los factores ambientales, temperatura y nivel de precipitación pluvial, entre otros, hay factores biológicos (presencia de ganado y otros reservorios), socioeconómicos (deforestación, urbanización e intensificación de la actividad agrícola y ganadera) que influyen en la presencia de los murciélagos vampiros y en la ocurrencia de casos; la distribución de estos quirópteros es cada vez más amplia y la RPB se ha extendido a regiones anteriormente libres de esta enfermedad. Barcenas y colaboradores en el 2015 mencionan que el nivel del mar no limita la presentación de casos y que se debe mantener un monitoreo constante para la detección oportuna de casos, así como la vacunación se debe realizar antes del comienzo de las lluvias, sin esperar la aparición de brotes.
Transmisión de la enfermedad
La transmisión de la enfermedad es horizontal, esto quiere decir que se realiza en forma directa de animal a animal, a través de las heridas provocadas por las mordidas de un individuo enfermo o infectado a un susceptible, pudiendo introducir de esta manera el virus presente en la saliva (Rivera, 2012).
La RPB es casi siempre transmitida por la inoculación del virus en la mordida producida por los murciélagos hematófagos o vampiros Desmodus rotundus portadores de la rabia, al alimentarse de la sangre del ganado bovino, sin embargo, se pueden alimentar con la sangre de cualquier otra especie de mamífero incluso del hombre. Aparte del ganado bovino, el ganado equino, caprino y ovino también constituyen especies con riesgo de ser infectadas, ya que forman parte del espectro de componentes de la dieta del vampiro común (Rivera, 2012).
El manejo del ganado y su relación con la presencia de casos
El manejo que los productores dan al ganado bovino desempeña un papel importante en la incidencia, ya que aumenta o disminuye la transmisión y presencia de casos de RPB. En algunas regiones de México se aplican diferentes sistemas de pastoreo extensivo y algunos de ellos generan un considerable movimiento de ganado en primavera y verano, épocas en la que hay mejores agostaderos. Existen estudios que sugieren que D. rotundus no tolera los climas fríos ni las bajas temperaturas del invierno, específicamente cuando son menores de 10 0C (Barcenas, et. al., 2015). En la variabilidad del número de casos influyen las condiciones climáticas que afectan al ciclo de vida del vector. Se estima que en áreas de alta densidad de murciélagos vampiros, un mismo bovino puede recibir hasta 12 mordeduras en una noche y alimentar hasta a cuatro de estos hematófagos a la vez.
Periodo de incubación
El período de incubación varía de cinco días a varios años (por lo general, dos a tres meses y raramente más de un año) dependiendo de:
El micro-ARN específico de los músculos puede contribuir a esta fase eclipse al suprimir la transcripción y replicación viral en el músculo. La velocidad estimada de la migración del virus depende de si se mueve por transporte axonal retrógrado (centrípeto) o por propagación centrífuga. En el transporte axonal retrógrado, la migración es rápida, con velocidades de 5-100 mm/día o incluso más rápidas, porque las poblaciones neuronales del mismo orden sináptico ubicadas a diferentes distancias, por ejemplo, de 10 µm a 2 cm, se infectan simultáneamente. Por el contrario, la propagación centrífuga es lenta, ya que probablemente está mediada por la difusión pasiva en lugar del transporte activo (OMS, 2018).
Patogenia y signología
La mayoría de los bovinos que aún no han sido vacunados y que fueron mordidos por vampiros rabiosos, presentan la enfermedad. Los primeros signos observados consisten en inquietud, falta de apetito, tendencia a aislarse y frecuentes vocalizaciones con un tono de voz diferente al habitual (Delprieto y Russo, 2011).
Posteriormente se observa depresión, deshidratación, dificultad postural y ambulatoria, principalmente en el tren posterior; los animales caen con frecuencia al suelo y se levantan con dificultad, hasta que finalmente quedan postrados en decúbito lateral. En los animales postrados se observan continuos movimientos de pedaleo y opistótonos (posición anormal, rígida y arqueada) que pueden dejar marcas en el suelo, micción gota a gota, abundante salivación y deposición seca y dura. Finalmente, aumenta la parálisis y la deshidratación, muriendo por esas causas entre los cinco y los 15 días posteriores al comienzo de los signos (Delprieto y Russo, 2011).
La presentación de signos, velocidad de las afectaciones y tiempo de muerte dependerá de varios factores como el tipo de curso que se presente la enfermedad (paralítica, furiosa o atípica), el estado general del animal y del clima. Los animales con buen estado nutricional y los que caen en lugares sombreados o en momentos de clima fresco, generalmente sobreviven más tiempo que los débiles y mal nutridos y que los que quedan caídos al sol durante el verano (Delprieto y Russo, 2011).
Control y prevención
Se ha demostrado que la vacunación previa a la exposición puede ser más eficiente y rentable que el control de los murciélagos hematófagos.
La Norma Oficial Mexicana NOM-067-ZOO-2007 establece que se debe vacunar al ganado en áreas endémicas desde el mes de nacido, con aplicaciones de refuerzo cuando cumplen tres y seis meses. Con este esquema se asegura la inmunización de los animales recién nacidos y durante la época de pastoreo
En las estrategias de vacunación es esencial considerar el ciclo reproductivo del murciélago hematófago. La gestación es en época de lluvias y la lactancia de agosto a noviembre en este sentido, está asociado con una mayor demanda de alimento y, en consecuencia, con un mayor número de ataques al ganado, lo que lleva a un mayor riesgo de ocurrencia de casos.
La vacunación con la más amplia cobertura, antes del comienzo de las lluvias, debe ser oportuna y aplicarse de manera inteligente y programada, sin esperar la aparición de brotes.
Medición de la respuesta de los anticuerpos a la vacunación antirrábica en animales
Las pruebas RIFFT (prueba rápida de inhibición de focos fluorescentes), FAVN (fluorescencia de neutralización del anticuerpo del virus) y ELISA (enzimoinmunoanálisis de adsorción) pueden emplearse para medir las respuestas inmunitarias posteriores a la vacunación en animales. Esto es importante cuando existe alguna incertidumbre sobre la calidad de la vacuna, el almacenamiento de la vacuna (por ejemplo, el mantenimiento de la cadena de frío) o la eficacia de la administración de la vacuna. Las muestras posteriores a la vacunación deben analizarse en el momento o cerca del momento, en el que se esperan títulos máximos (aproximadamente cuatro semanas después de la vacunación). Los resultados serológicos de las muestras recogidas después de este tiempo pueden ser difíciles de interpretar, ya que los títulos de anticuerpos pueden disminuir rápidamente, aunque los animales aún estén protegidos contra la infección.
Como resultado de la tasa variable y potencialmente rápida de disminución de anticuerpos, las pruebas serológicas realizadas más de cuatro semanas después de la vacunación no se recomiendan para monitorear la cobertura post vacunal o la inmunidad de la población. La prueba RIFFT se recomienda a efectos del traslado y comercio internacional de animales denominándose, así como la “prueba de oro” por la OMS (organización mundial de la salud) y la OIE (Organización Mundial de Sanidad Animal). Tanto las pruebas de neutralización del virus (por ejemplo, RIFFT y FAVN) como ELISA son adecuadas para controlar la respuesta de los anticuerpos de los animales vacunados en el marco del control de la rabia (OMS, 2018).
TRABAJO DE INVESTIGACIÓN EN CAMPO:
Evaluación de los títulos de anticuerpos neutralizantes contra rabia en bovinos vacunados con una dosis única con cepa SAD, virus activo modificado
Con el objetivo de evaluar los títulos de anticuerpos neutralizantes contra rabia en bovinos vacunados con una dosis única cepa SAD, virus activo modificado, se realizó un estudio en un sistema de ganadería extensiva con pastoreo continuo en el “Rancho Jaltitan” municipio de Ixtlahuacán del Río, Jalisco, México donde se utilizaron veintiséis becerros ambos sexos, entre seis y once meses de edad, cruzados de limousin con charoláis, clínicamente sanos y con títulos de anticuerpos menores a 0.6 UI/ml contra rabia paralítica bovina (RPB). Se realizó un diseño completamente al azar, donde los animales fueron divididos en dos grupos bajo mismas condiciones de alojamiento y alimentación, uno fue testigo y al otro se le administró la vacuna en investigación el día 0. Se recolectaron muestras de sangre los días 7, 14, 21 y 45 posteriores a la vacunación para obtener el suero. La determinación de anticuerpos se realizó con la prueba rápida de inhibición de focos fluorescentes. Los datos obtenidos se procesaron con análisis de varianza y desviación estándar. Se observa que el día siete postvacunación el tratamiento con cepa SAD mostró niveles de anticuerpos de 0.44 UI/ml, el día 14 =2.22 UI/ml, el día 21 = 2.97 UI/ml y 3.53 UI/ml al día 45. En el grupo testigo se observaron los niveles de anticuerpos durante todo el estudio inferiores a 0.6 UI/ml. Se concluye que la vacuna contra la rabia cepa SAD estimuló adecuadamente la seroconversión de anticuerpos vacunales contra la rabia paralítica en bovinos a partir del día 14 (Gráfica 3).
Gráfica 3: Títulos promedios de anticuerpos a través del tiempo contra la rabia en bovinos
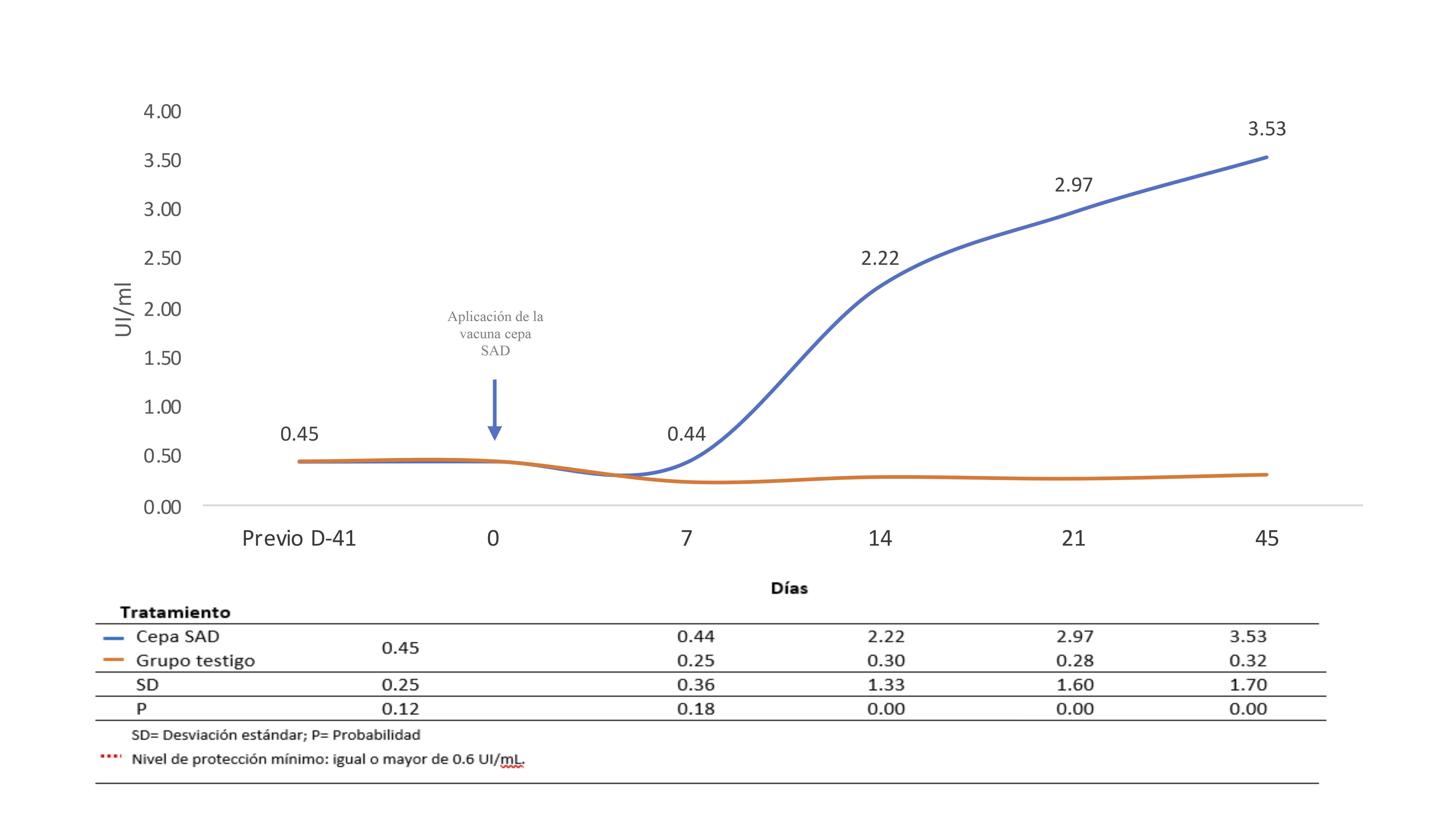
Grafica03 Rabia
La rabia es una enfermedad viral mortal que afecta tanto a animales como a los humanos. La rabia que se transmite por animales silvestres se encuentra aún desatendida y existe todavía mucha falta de información. En el continente americano los murciélagos hematófagos son la principal fuente de casos de rabia humana y en el ganado. En México en el año 2021 se reportaron un total de 230 focos de rabia paralítica bovina, encontrándose principalmente en los estados de Veracruz, Nayarit, Puebla, Chiapas, Yucatán, Jalisco, San Luís Potosí, Guerrero e Hidalgo. Se considera que, por cada caso de rabia notificado, existen diez que no se informan. Estudios recientes mencionan que la rabia paralítica bovina se ha extendido a regiones anteriormente libres. La vacunación previa a la exposición en especies ganaderas y silvestres se considera lo más eficiente y rentable para el control y erradicación de la rabia. La Vacuna contra el Derriengue de laboratorio BIO ZOO (Cepa SAD) protege adecuadamente a los bovinos contra la Rabia Paralítica Bovina a partir del día 14.
BIBLIOGRAFIA
Ajorloo M, Mirzaei H, Sadeghi Y, Tarban N, Soltani S, Mohammadi F, Davarinejad P, Amiri M, Reza H, Abouhamzeh K, Mohammadhosayni M, Razavi H, Alamdary A, Norouzi, M. Evaluation and Phylogenetic Analysis of Regular Rabies Virus Vaccine Strains. Arch Iran Med. 2018; 21 (3): 101-110.
Bárcenas-Reyes I, Loza-Rubio E, Zendejas-Martínez H, Luna-Soria H, Cantó-Alarcón GJ, Milián-Suazo F. Comportamiento epidemiológico de la rabia paralítica bovina en la región central de México, 2001-2013. Revista Panamericana de Salud Pública. 2015; 38(5): 396-402.
Gold S, Donnelly CA, Nouvellet P, Woodroffe R. Rabies virus-neutralising antibodies in healthy, unvaccinated individuals: What do they mean for rabies epidemiology?. PLOS Neglected Tropical Diseases. 2020; 14(2): e0007933.
Johnson N, Phillpotts R, Fooks AR. Airborne transmission of lyssaviruses. Journal of Medical Microbiology. 2006; 55(6): 785-790.
Mehta S, Charan P, Dahake R, Mukherjee S, Chowdhary A. Molecular characterization of nucleoprotein gene of rabies virus from Maharashtra, India. Journal of Postgraduate Medicine. 2016; 62(2): 105.
NOM-067-ZOO-2007: Campaña nacional para la prevención y control de la rabia en bovinos y especies ganaderas. SECRETARIA DE AGRICULTURA, GANADERIA, DESARROLLO RURAL, PESCA Y ALIMENTACION: Primera sección, Diario oficial, 20 de mayo 2011.
OMS, 2018. Organización Mundial de la Salud. Consulta de Expertos de la OMS sobre Rabia. Tercer informe. WHO Technical Report Series, No.1012.
OMSA, 2021. Organización mundial de sanidad animal (Antes OIE). Código Sanitario para los animales terrestres. Infección por el virus de la rabia. Capítulo: 8.14.2, pág. 2. Consultado en: https://www.woah.org/fileadmin...
PRONABIVE. Productora Nacional de Biológicos Veterinarios. 2021. Consultado en: https://www.gob.mx/pronabive/a...
Winkler WG, Fashinell TR, Leffingwell L, Howard P, Conomy JP. Airborne rabies transmission in a laboratory worker. Jama. 1973; 226(10): 1219-1221
Delpietro H, Russo, G. Manual de procedimientos de rabia paresiante. Primera Edición. Servicio Nacional de Sanidad y Calidad Agroalimentaria. Buenos Aires Argentina: 2011.
Rivera, E. 2012. Rabia Paralítica Bovina. Tesis de grado para obtener el título de Médico Veterinario Zootecnista. División Regional de Ciencia Animal. Universidad Autónoma Agraria Antonio Narro. Unidad Laguna. Torreón, Coahuila, Méx.
SENASA. 2020. Costa Rica. Informe sobre caso confirmado de rabia paralitica bovina en Puriscal, Mercedes Sur, Caserio San Vicente (Cuadrícula 1564, Finca 104-073690) Informe Número 1.20 de mayo 2020.© Documento normativo propiedad del SENASA. El documento vigente se encuentra en internet; cualquier versión impresa es una copia no controlada.